曹雪涛院士团队发现E3泛素连接酶TRIM41增强抗病毒天然免疫功能及机制
2021年2月28日,《Signal Transduction andTargeted Therapy》在线发表了曹雪涛院士团队的论文“TRIM41 is required to innate antiviralresponse by polyubiquitinating BCL10 and recruiting NEMO”,该研究发现了E3泛素连接酶TRIM41能够增强巨噬细胞抗病毒天然免疫应答并揭示了其新型作用机制。
天然免疫系统是人类抵御外界病原体感染和入侵的第一道防线,抗病毒免疫是天然免疫系统的重要组成部分。天然免疫细胞如何通过模式识别受体(PRR)敏感而特异性地识别病毒感染并诱导I型干扰素产生以清除病毒的分子机制,是当今免疫学领域的重要科学问题之一。E3泛素连接酶作为介导泛素化修饰的关键成员,其参与天然免疫调控的研究一直是研究热点。另外,CARD蛋白(caspase recruitment domain)-BCL10(B cell lymphoma 10)-MALT1(mucosa-associated-lymphoidtissue lymphoma-translocation gene 1)信号复合体, 也被称为CBM复合体,它可以调控多种受体(主要为TCR/BCR受体)下游NF-κB信号通路的活化。然而, CBM复合体是否在天然免疫受体尤其是胞内核酸受体下游发挥调控功能又是如何参与抗病毒天然免疫应答的,一直知之甚少。
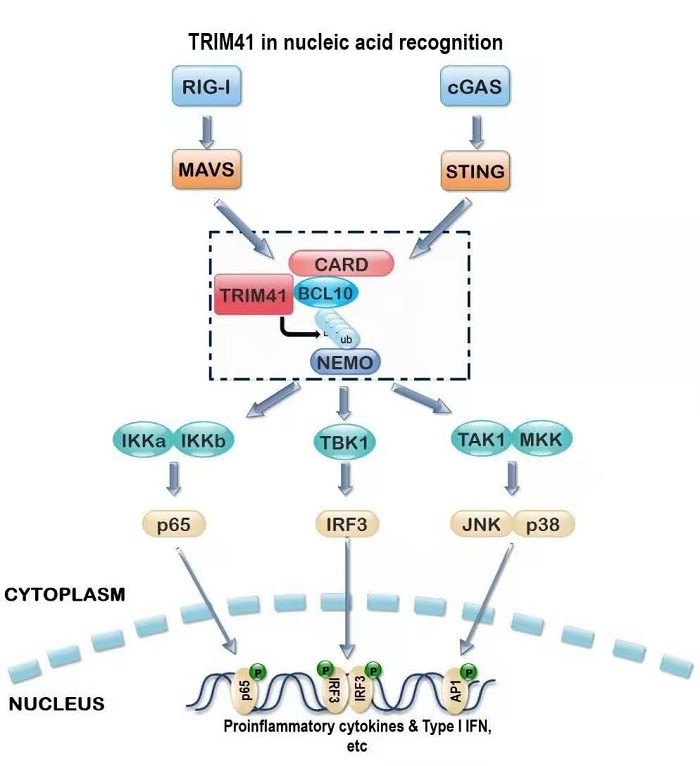
本研究利用VSV感染巨噬细胞模型和基因芯片技术分析了对VSV感染存在反应性的E3泛素连接酶并利用小RNA干扰技术对这些E3在抗病毒天然免疫应答中的功能进行了筛选,发现干扰或敲除TRIM41可以抑制巨噬细胞内核酸类似物及相关病毒、细菌介导的IL-6、TNF-α以及IFNβ的产生。在敲除TRIM41的小鼠中,VSV、HSV-1以及李斯特菌所诱导产生的炎症因子和干扰素的水平更低,肝脏的损伤和炎性改变更少,但病原体在TRIM41敲除小鼠组织器官中的生长能力更强,导致了小鼠的生存期明显缩短。信号通路研究发现,TRIM41可以促进NF-κB、JNK、p38以及TBK1-IRF3信号的活化。机制研究发现,TRIM41可以与BCL10直接结合并促进其K63多聚泛素化修饰,从而将包括NEMO在内的IKK信号复合体和TAK1、TBK1招募至MAVS、STING信号复合体,介导核酸受体下游信号的活化,促进炎性因子和干扰素的产生。该研究首次揭示了TRIM41通过促进BCL10的K63多聚泛素化修饰及其对NEMO的招募促进抗RNA和DNA病毒的天然免疫应的新功能,发现了CBM复合体参与天然免疫核酸受体下游信号复合体的组成及活化的新现象,为抗感染免疫与炎症相关疾病的干预提供了新的理论基础与思路。
本文的共同通讯作者为曹雪涛院士及医学免疫学国家重点实验室陈涛涌教授,系统所副研究员俞宙博士、浙江大学免疫学研究所李雪莲博士和医学免疫学国家重点实验室副教授杨明金博士为本文共同第一作者。该项研究得到了国家自然科学基金, 国家重点研发计划等多个项目的资助。


 您现在的位置:
您现在的位置:
 返回上一级
返回上一级