基础医学研究所何维张建民团队与美国国立卫生研究院陈万军教授合作发现转化生长因子β调控肠上皮间TCRγδ+CD8αα+淋巴细胞发育和功能的新机制
2023年5月30日,中国医学科学院基础医学研究所何维张建民团队与美国国立卫生研究院陈万军教授团队合作在Cell Discovery《细胞发现》在线发表题为“TGF-β controls development of TCRγδ+CD8αα+ intestinal intraepithelial lymphocytes” (转化生长因子β调控肠上皮间TCRγδ+CD8αα+淋巴细胞发育和功能的新机制)的研究论文,揭示了转化生长因子β(TGF-β)在肠上皮间TCRγδ+CD8αα+淋巴细胞的发育和功能方面的重要调控作用。

一般认为,γδT细胞起源于胸腺的CD4-CD8-双阴性(DN)细胞,因而位于外周血和其他组织部位的γδT细胞几乎不表达CD8,但定植在肠上皮细胞间的γδT细胞,即γδ IEL中,约90%可特异性表达CD8αα。目前为止,关于这群细胞经历了怎样的发育过程、该过程受到哪些因素的调控、为何会特异性表达CD8、有哪些功能特点等问题还尚不清楚。
本研究团队发现TGF-β是TCRγδ+CD8αα+IEL发育过程中的关键影响因素,可以通过直接作用于不同发育阶段的γδT细胞的直接调控方式和以肠上皮细胞为媒介的间接调控方式来综合调节TCRγδ+CD8αα+IEL的整个发育过程。同时,TGF-β信号还对γδ IEL在肠道局部行使保护肠黏膜屏障完整性的功能具有重要作用。
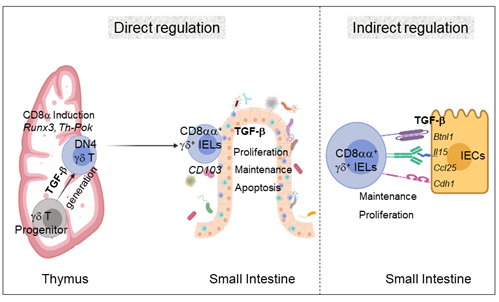
TGF-β对TCRγδ+CD8αα+IEL发育的直接调控和间接调控(图源自Cell Discovery)
通过利用CD45.1、Rag1-/-和Tgfbr1 Esr1-Cre等小鼠建立的骨髓细胞移植模型,我们观察到TGF-β信号缺陷的骨髓细胞经过在Rag1-/-小鼠体内发育后,定植在肠上皮间的TCRγδ+CD8αα+IEL细胞的比例和数量显著减少。并且在γδT细胞上特异性敲除TβR1的小鼠(Tgfbr1f/f TCR δER Cre)中也观察到同样的现象。此外作者还通过检测TGF-β信号下游分子Smad3和Smad2缺陷的小鼠(Smad3-/-和Smad2/3dko)中的TCRγδ+CD8αα+IEL细胞亚群,发现TGF-β对TCRγδ+CD8αα+IEL发育的调控依赖下游Smad2 /Smad3通路。
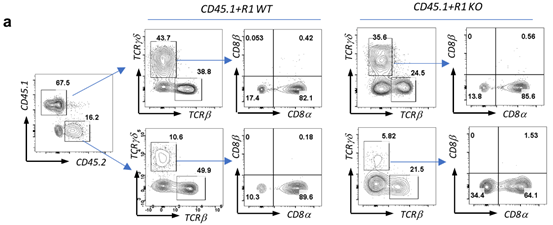
图片源自Cell Discovery
接下来我们探究了TGF-β对不同发育阶段的γδT细胞的作用。首先在胸腺内,TGF-β信号的存在可以保证γδT细胞在发育过程中产生充足的γδ IEL前体细胞,同时通过调控Runx3和Th-Pok的表达使γδT细胞具有表达CD8α+的潜力。其次在γδT细胞从胸腺迁移并定植到肠道的过程中,TGF-β信号主要通过维持肠道局部TCRγδ+CD8αα+IEL细胞表达的CD103水平来使其长久驻留在肠道部位。最后对于已经定植在肠上皮间的TCRγδ+CD8αα+IEL,TGF-β信号还可以抑制其过度活化从而保持其存活能力,并调控其增殖能力以维持肠道局部的免疫稳态。
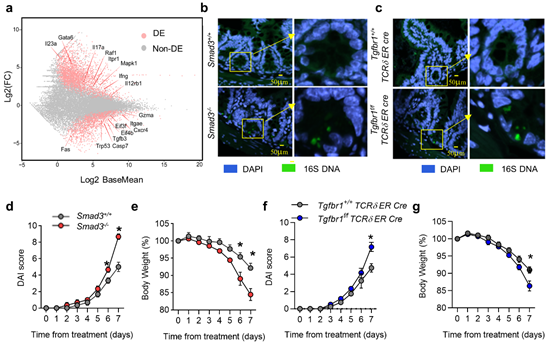
图片源自Cell Discovery
肠上皮细胞(Intestinal Epithelial Cell, IEC)与TCRγδ+CD8αα+IEL的发育和功能有着密切联系。一方面,肠上皮细胞为TCRγδ+CD8αα+IEL提供了特殊的发育环境,另一方面,TCRγδ+CD8αα+IEL也在肠上皮细胞传导的免疫信号调控下,时刻围绕肠上皮运动并行使免疫监视和维持局部黏膜免疫稳态的功能。本研究团队通过将γδ IEL与TGF-β信号缺陷的IEC共培养,以及将C57BL/6小鼠的骨髓细胞移植到TGF-β信号缺陷(Smad3-/-)的小鼠中发育等实验,验证了IEC上TGF-β信号缺陷时,TCRγδ+CD8αα+IEL的发育会显著受到影响。同时,在缺乏TGF-β信号时,γδ IEL保护肠道粘膜的完整性和防止病原微生物入侵的能力也有所下降,DSS诱导时也表现出更严重的炎症性肠病症状。
总体来讲,该研究全面系统地阐述了TGF-β对肠道TCRγδ+CD8αα+IEL细胞发育和功能的调控机制,并强调了TGF-β信号介导下的肠上皮细胞在其中的重要作用,为进一步认识TGF-β信号在机体肠道区域粘膜免疫系统形成和免疫应答过程中所起的作用提供了重要科学依据。
本研究工作得到国家自然科学基金(U20A20374)、国家重点研发计划(2022YFC3602000)以及美国国立卫生研究院牙颌和颅面部研究所内部研究项目的资助。基础所何维教授、张建民教授、美国国立卫生研究院陈万军教授为该论文共同通讯作者,基础所和美国国立卫生所研究院联合培养博士韩佳佳为该论文的第一作者。
论文链接:https://www.nature.com/articles/s41421-023-00542-2


 您现在的位置:
您现在的位置:
 返回上一级
返回上一级