医学分子生物学国家重点实验室 举办2023年第一次青年沙龙会议
为推进开放交流,增进科研融合,基础所医学分子生物学国家重点实验室自2016年起定期举办“青年沙龙”学术会议。会议营造了良好的学术氛围,为中青年科研教学人才的交流提供了平台。
近期,重点室召开了本年度第一次“青年沙龙”活动,由黄波教授课题组的吕家迪助理研究员报告,李隽研究员主持。吕家迪助理研究员以“Epigenetic modification of CSDE1 locus dictates immune recognition of nascent tumorigenic cells”为题,介绍了如何通过利用单细胞成瘤模型, 阐明CSDE1介导初始肿瘤细胞发生免疫逃逸的表观遗传调控新机制。

肿瘤发生是基因突变的结果。然而,DNA突变却是一个正常的生理现象,其在正常人体细胞中高频出现。DNA突变作为一种随机事件,在绝大多数情况下,其会导致细胞死亡或不产生显著影响;但是极少数情况下,DNA突变将导致细胞转化成为肿瘤细胞。尽管DNA突变导致正常细胞恶性转化的几率非常低,但由于机体内DNA突变的累计量极其巨大,使得机体出现肿瘤细胞成为一个不可避免的结局,并在个体中普遍存在。尽管如此,这些肿瘤细胞并不等同于肿瘤。在人群中,只有极少数个体的肿瘤细胞最终发展成为有临床症状的肿瘤,即我们常说的“得了肿瘤”。那么,同样是恶性转化的肿瘤细胞,为什么出现“长肿瘤”亦或“不长肿瘤”的不同结局?这其中的一个重要原因是机体存在强大的免疫监视,特别与一类称之为CD8+ T细胞的关键免疫细胞相关,其识别肿瘤细胞表面的肿瘤抗原并进而将肿瘤细胞杀灭。然而,总有少数肿瘤细胞能够逃避CD8+ T细胞的识别和杀伤,特别是突变所致的肿瘤细胞在最初形成之际,该初始肿瘤细胞面临接受免疫监视抑或逃逸监视的选择,从而决定肿瘤的最终命运,因此,阐明该事件背后的机制是肿瘤免疫研究的核心问题,但却一直是一个谜团,这主要归结于缺乏相应的肿瘤模型(一个肿瘤细胞长出一个肿瘤)和手段。

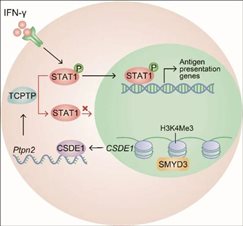
吕家迪老师所在实验室前期建立的三维纤维蛋白软凝胶培养系统,能够在体外实现筛选、富集并扩增肿瘤干细胞,并将这类3D培养细胞称为肿瘤再生细胞。在此基础上,吕家迪老师进一步建立了单个肿瘤再生细胞在免疫正常小鼠体内成瘤的研究模型。研究表明肿瘤干细胞的形成不仅受到化学信号的影响,而且还受到生物机械力信号的调控。既往研究也表明,肿瘤微环境中生物机械力在调控肿瘤干细胞的形成及维持其干性方面起着至关重要的作用,但尚未清楚其对免疫逃逸有何影响。吕家迪老师通过转录组测序等高通量技术筛选出关键差异表达分子CSDE1,敲除CSDE1的肿瘤干性细胞只能在免疫缺陷小鼠体内成瘤,而无法在免疫正常小鼠中成瘤。这意味着CSDE1很可能在肿瘤免疫逃逸中发挥着重要作用。随后的研究表明,肿瘤微环境的机械力信号通过SMYD3(一种参与癌细胞增殖的组蛋白甲基转移酶)表观遗传修饰调控CSDE1,高表达CSDE1的肿瘤干细胞可以通过稳定T细胞蛋白酪氨酸磷酸酶(TCPTP)的mRNA进而上调其表达量,而TCPTP识别磷酸化的酪氨酸位点,使转录激活因子1(STAT1)去磷酸化而失活,进而下调MHCI分子的表达。这些工作从生物机械力学角度揭示了肿瘤免疫逃逸的新机制,为开发新的肿瘤免疫治疗及生物治疗策略提供理论基础,对于肿瘤的早期预防和免疫治疗预后具有重要意义。
报告末尾,吕家迪老师进行了简略的总结。在交流环节,现场气氛热烈,在座的各位老师和同学积极踊跃,不断提出有意义的问题和见解,吕家迪老师都逐一进行了详细的解答。最后,“青年沙龙”学术报告活动在一片热烈的掌声中结束。


 您现在的位置:
您现在的位置:
 返回上一级
返回上一级