基础医学研究所许海燕团队研发CXCR4拮抗多肽-金纳米棒偶联物用于三阴性乳腺癌光热免疫治疗
2023年4月5日,中国医学科学院基础医学研究所许海燕团队在《美国化学学会应用材料与界面》(ACS applied Materials & Interfaces)杂志发表了题为“CXC Chemokine Receptor Type 4 Antagonistic Gold Nanorods Induce Specific Immune Responses and Long-Term Immune Memory to Combat Triple-Negative Breast Cancer”(CXCR4拮抗多肽偶联金纳米棒通过诱导特异性免疫反应和长期免疫记忆治疗三阴性乳腺癌)的论文,报道了一种将拮抗多肽与光热转换材料金纳米棒相结合的新型偶联物制备及用于三阴性乳腺癌光热免疫治疗的策略。
三阴性亚型乳腺癌因缺乏特异性治疗靶点而难以从内分泌治疗和靶向治疗中获益,其治疗极具挑战。我们的研究显示,三阴性乳腺癌的CXCR4表达显著高于其他亚型,有望作为三阴性乳腺癌治疗的潜在靶点。研究团队将自主研发的CXCR4拮抗多肽(E5)与具有优异光热转换效率的金纳米棒(AuNRs)相结合,构建了偶联物AuNRs-E5。本团队的研究结果表明,AuNRs-E5可通过与细胞表面CXCR4结合而发挥其拮抗功能,与此同时,将更多的AuNRs带入胞内并定位于CXCR4丰富的内质网,使细胞在瞬时激光照射下产生内质网应激,发生更为强烈的免疫原性死亡。在小鼠乳腺癌模型上,AuNRs-E5治疗有效逆转了乳腺癌组织的免疫抑制状态,诱导了特异性免疫应答和免疫记忆效应,从而抑制了三阴性乳腺癌的转移和复发,显著延长小鼠生存期(图1)。
此项研究的创新特色是将纳米光热材料与具有CXCR4特异性识别、拮抗、内质网定位功能的多肽相结合,构建新型多肽偶联物,在拓展多肽-药物偶联物的同时,发展了纳米光热免疫治疗策略,在三阴性乳腺癌的治疗方面具有重要临床转化应用前景。
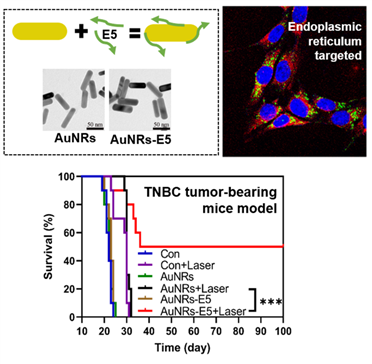
图1. 金纳米棒与CXCR4拮抗多肽偶联物(左上)定位于肿瘤细胞内质网(右上),通过引发光热免疫效应显著延长三阴性乳腺癌荷瘤小鼠的生存期。
此项研究得到中国医学科学院医学与健康科技创新工程(2021-1-I2M-026)、国家重点研发(2017YFA0205504)及国家自然科学基金(81801771, 81870133, 32171343)等项目的资助。基础医学研究所许海燕研究员和温涛副研究员为论文通讯作者,基础医学研究所博士生蒙艺灵和北京协和医学院临床医学八年制学生周家伟为论文的共同第一作者。


 您现在的位置:
您现在的位置:
 返回上一级
返回上一级